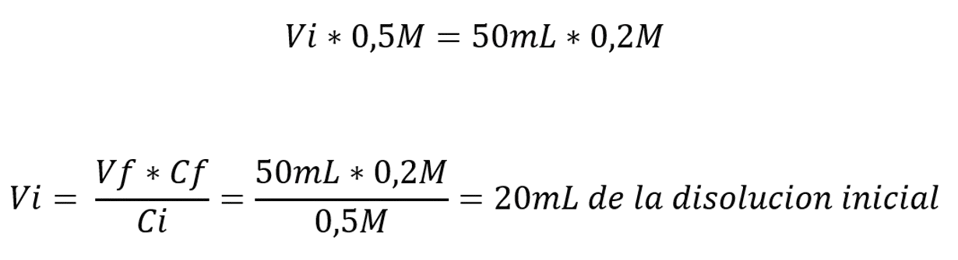En un laboratorio uno de los factores mas importantes a tener en cuanto es la exactitud y la precisión, con estas se consigue obtener datos fiables. Una manera de demostrar la fiabilidad en el laboratorio es mediante el calculo y la estadística, esta demuestra si el experimento/análisis es fiable. Los cálculos en laboratorio abarcan una amplia gama de conceptos teóricos y aplicaciones prácticas, pero en este apartado solo veremos los cálculos de disoluciones, estos son un básico en todo laboratorio que requiera preparar disoluciones con reactivos.
Las diluciones son necesarias cuando se necesita ajustar la concentración de una solución para un experimento específico, por esta razón, son cálculos muy comunes en cualquier laboratorio. ¿Así pues, como se realizan estos cálculos?
Al momento de preparar disoluciones existen 4 casos posibles dependiendo del reactivo que tengamos, estos son:
- Preparar una disolución con un soluto solido anhidro comercial.
- Preparar una disolución con un soluto solido hidratado comercial.
- Preparar una disolución con un soluto líquido comercial.
- Preparar una disolución diluida a partir de una disolución más concentrada.
Así pues, vayamos uno por uno explicando como calcular en casa caso y en como se diferencian cada una.
Preparar una disolución con un soluto solido anhidro comercial
Un soluto solido anhidro comercial es aquel reactivo solido que se compra que no posee moléculas de agua, no pose agua, para realizar disoluciones con este tipo de reactivo deberemos tener en cuenta los siguientes valores:
- El volumen para preparar (normalmente se calcula en ml, L)-> La que nosotros deseemos.
- La concentración que queremos que tenga la disolución a preparar (moles/L, ppm, g/L) -> La que nosotros deseemos.
- Peso molecular del soluto (g/mol) -> Tiene que estar apuntado en envase donde viene el reactivo.
- La riqueza o pureza del soluto en % (g/ soluto puro /100g disolución) -> Tiene que estar apuntado en envase donde viene el reactivo.
Cuando sepamos estos valores la fórmula es la siguiente:

- El volumen para preparar (normalmente se calcula en ml, L).
- La concentración que queremos que tenga la disolución a preparar (moles/L, ppm, g/L).
- Peso molecular del soluto (g/mol).
- La riqueza o pureza del soluto en % (g/ soluto puro /100g disolución), en caso de que no se facilite se considera que es 100%.
Ejemplo: Queremos preparar 150mL de HCl 0,5M partiendo de un HCl comercial que tiene un 90% de pureza. ¿Cuántos gramos de HCl necesitaremos? (Peso molecular HCl = 36,46 g/mol).
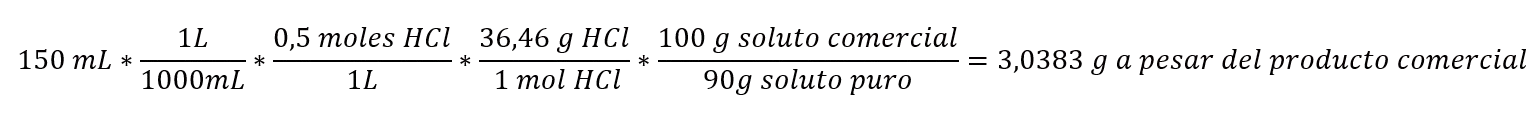
Si nos dieran la concentración del reactivo en g/L se omite el peso molecular (3):
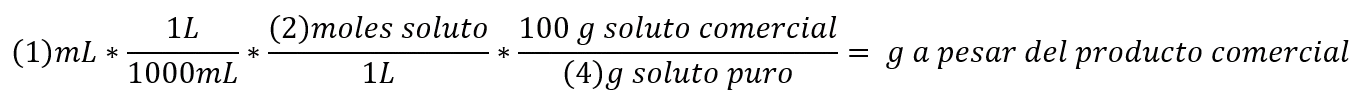
Preparar una disolución con un soluto solido hidratado comercial
Un soluto solido hidratado comercial es aquel reactivo solido que se compra que posee moléculas de agua, pose agua. Para realizar disoluciones con este tipo de reactivo deberemos tener en cuenta los siguientes valores:
- El volumen para preparar (normalmente se calcula en ml, L).
- La concentración que queremos que tenga la disolución a preparar (moles/L, ppm, g/L).
- Peso molecular del soluto hidratado (g/mol).
- La riqueza o pureza del soluto en % (g/ soluto puro /100g disolución), en caso de que no se facilite se considera que es 100%.
Cuando sepamos estos valores la fórmula es la siguiente:
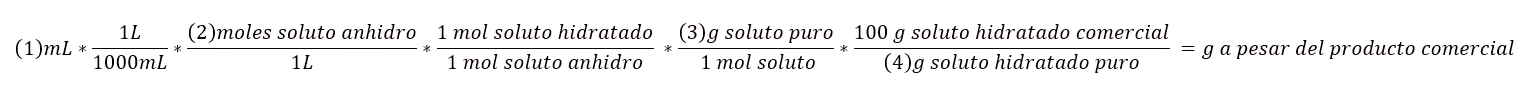
- El volumen para preparar (normalmente se calcula en ml, L).
- La concentración que queremos que tenga la disolución a preparar (moles/L, ppm, g/L).
- Peso molecular del soluto (g/mol).
- La riqueza o pureza del soluto en % (g/ soluto puro /100g disolución), en caso de que no se facilite se considera que es 100%.
Ejemplo: Calcula la masa de CuSO4*5H20 con riqueza del 90% para preparar 100mL de disolución acuosa al 0,5M en masa de CuSO4. (Peso molecular CuSO4*5H20 = 249,68 g/mol).
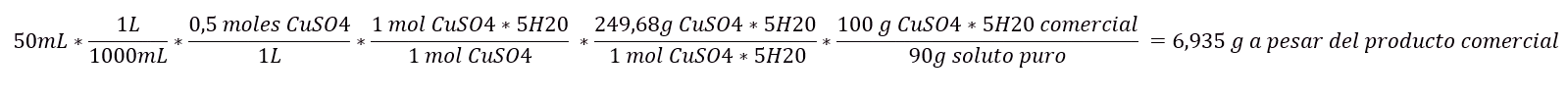
Si nos dieran la concentración del reactivo en g/L se tendría que incluir el peso molecular del soluto anhidro (5):

Preparar una disolución con un soluto líquido comercial
Un soluto líquido comercial es aquel reactivo líquido que se compra a un fabricante. Para realizar disoluciones con este tipo de reactivo deberemos tener en cuenta los siguientes valores:
- El volumen para preparar (normalmente se calcula en ml, L).
- La concentración que queremos que tenga la disolución a preparar (moles/L, ppm, g/L).
- Peso molecular del soluto hidratado (g/mol).
- La riqueza o pureza del soluto en % (g/ soluto puro /100g disolución).
- La densidad del producto comercial (g de producto comercial/ mL de disolución comercial).
Cuando sepamos estos valores la fórmula es la siguiente:

- El volumen para preparar (normalmente se calcula en ml, L).
- La concentración que queremos que tenga la disolución a preparar (moles/L, ppm, g/L).
- Peso molecular del soluto hidratado (g/mol).
- La riqueza o pureza del soluto en % (g/ soluto puro /100g disolución).
- La densidad del producto comercial (g de producto comercial/ mL de disolución comercial).
Ejemplo: Queremos preparar 200mL de solución acido clorhídrico (HCl) 0,2M a partir de un ácido comercial con una pureza del 85% y una densidad de 2,37g/mL. ¿Qué volumen debemos pipetear de la solución? (Peso molecular HCl = 36,46 g/mol).
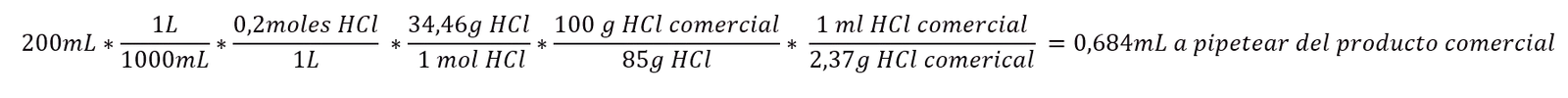
Preparar una disolución a partir de una disolución más concentrada
Podemos crear disoluciones más diluida o concentrada a partir de otra disolución hecha con anterioridad. Para realizar este tipo de disoluciones deberemos tener en cuenta los siguientes valores:
- El volumen final para preparar de disolución (normalmente se calcula en ml, L).
- La concentración final que queremos que tenga la disolución a preparar (moles/L, ppm, g/L).
- El volumen inicial de la disolución concentrada (debe de estar en las mismas unidades que el volumen final).
- La concentración inicial de la disolución concentrada (debe de estar en las mismas unidades que la concentración final).
Cuando sepamos estos valores la fórmula es la siguiente:

- (Vi) Volumen inicial
- (Ci) Concentración inicial
- (Vf) Volumen final
- (Cf) Concentración final
Ejemplo: Queremos preparar 50ml de NaCl de concentración 0,2M, tenemos en el laboratorio un litro de NaCl 0.5M. ¿Cuánto volumen necesitaremos del litro para preparar la disolución?