Toda persona que este metido en el “mundillo” de la ciencia conoce o/y ha oído hablar de la tabla periódica. Esta, como dice su propio nombre, es una tabla con todos los elementos conocidos en la actualidad y los organiza según las propiedad químicas y físicas que tengan los elementos. En esta sección, desglosaremos la estructura y el uso de la tabla periódica.
Existen diferentes variedades de tabla periódica, pero nosotros examinaremos la más común y la que deberás de conocer un poco por encima.
Estructura
La tabla periódica esta diseñada para mostrar las propiedades de los elementos de una manera que sea fácil de comprender y utilizar. En la gran mayoría de tablas periódicas que se utilizan en cada elemento se adjunta información como el peso molecular, el numero atómico, el símbolo químico, el nombre completo del elemento y mas.
La tabla periódica está dividida en filas horizontales llamadas períodos y columnas verticales llamadas grupos. Cada período corresponde a una capa de electrones. A medida que avanzamos de izquierda a derecha a lo largo de un periodo los elementos ganan protones y electrones, esto generalmente corresponde a un aumento de la reactividad y el cambiar sus propiedades físicas y químicas.
Cada grupo corresponde a elementos que comparten características químicas similares debido a la configuración de sus electrones en la capa externa.
La tabla periódica también se divide en diferentes bloques, estos son los bloques S, P, D y F. Esta clasificación se basa en el tipo de orbital en el que reside el electrón de mayor energía. Los bloques S y P corresponden a los elementos principales, los bloques D contienen los elementos de transición y el bloque F incluye los lantánido y actínidos (comúnmente llamados elementos de “tierras raras”).
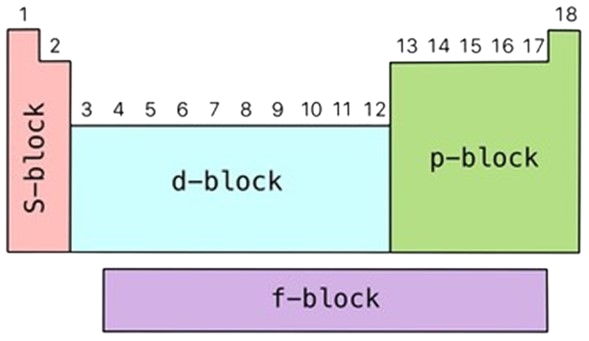
La estructura de la tabla periódica se pensó en todas estas características, pero esto diferente de que “tipo” de elemento es. Actualmente, los elementos de se dividen según si son metales, no metales, semimetales o gases nobles.
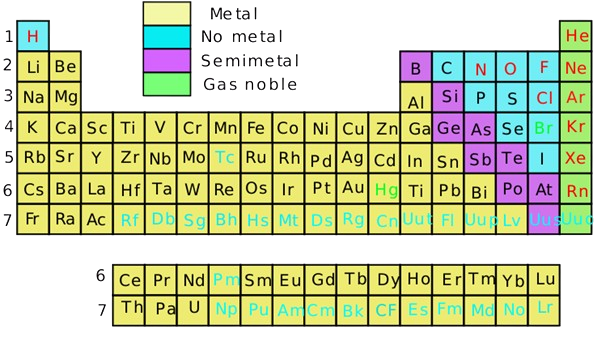
Elementos Notables
La primera versión de la tabla periódica (en 1869) presentaba 60 elementos conocidos, en la actualidad, se han descubierto muchos más, llegando a 118 elementos químicos. Recordarlos todos es difícil y más, cuando algunos elementos, son muy difíciles de encontrar.
Así pues, hay ciertos elementos que son particularmente importantes debido a sus propiedades únicas y a su amplia aplicación en diversos campos:
- Carbono (C): Es la base de la química orgánica siendo el elemento esencial de la vida formando el esqueleto de las moléculas orgánicas como proteínas, lípidos y ácidos nucleicos.
- Oxígeno (O): Elemento crucial para la respiración celular y la combustión. Constituye alrededor del 21% de la atmósfera terrestre y es un componente vital del agua.
- Nitrógeno (N): Este es el componente principal de la atmósfera terrestre (78%). Es esencial para la síntesis de proteínas y ácidos nucleicos en los organismos vivos.
- Metales Alcalinos (Grupo 1): Incluyen elementos como el sodio (Na) y el potasio (K), que son altamente reactivos y esenciales para diversas funciones biológicas.
- Halógenos (Grupo 17): Elementos como el cloro (Cl) y el flúor (F), que son altamente reactivos y utilizados en desinfectantes y productos químicos industriales.
- Gases Nobles (Grupo 18): Elementos como el helio (He) y el argón (Ar), conocidos por su baja reactividad y uso en aplicaciones donde se requieren condiciones inertes.